Clofoctol là thuốc điều trị n.hiễm t.rùng đường hô hấp. Nghiên cứu gần đây của các nhà khoa học cho thấy, loại kháng sinh này có nhiều hứa hẹn trong điều trị COVID-19 ở chuột.
Ước tính rằng 65,7% dân số thế giới hiện đã được tiêm ít nhất một liều vaccine COVID-19. Mặc dù vaccine COVID-19 làm giảm nguy cơ mắc bệnh nghiêm trọng, nhưng không ngăn chặn hoàn toàn sự lây truyền virus. Do đó, việc tiếp tục phát triển các loại thuốc an toàn và hiệu quả để điều trị COVID-19 là cấp thiết.
Tuy nhiên, quá trình đưa một loại thuốc mới ra thị trường rất gian nan. Có một số giai đoạn phát triển t.iền lâm sàng và lâm sàng mà một ứng viên thuốc phải tiến hành thành công trước khi nó có thể được phép sử dụng cho con người. Đối mặt với tình trạng khẩn cấp về sức khỏe cộng đồng – như đại dịch toàn cầu COVID-19 – các mốc thời gian dài liên quan đến quá trình này sẽ trở thành một trở ngại lớn đối với một loại thuốc mới.
Vì vậy, các nhà nghiên cứu đã cố gắng sử dụng lại các loại thuốc hiện có để điều trị COVID-19, bao gồm remdesivir, hydroxychloroquine và ribavirin. Tuy nhiên, hiệu quả của các thuốc này thường bị hạn chế và đôi khi gây tranh cãi. Song việc sử dụng lại các loại thuốc hiện có để điều trị COVID-19 sẽ giúp rút ngắn thời gian nghiên cứu.
Thử nghiệm thuốc trên các mô hình chuột mắc COVID-19, đã ghi nhận rằng clofoctol làm giảm tải lượng virus.
Trong nghiên cứu hiện tại, các nhà khoa học đã phân tích 1.942 loại thuốc đã được phê duyệt, để xác định các phân tử có thể ức chế hoạt động của SARS-CoV-2. Trong số các hợp chất được kiểm tra, 21 hợp chất có hoạt tính kháng virus đáng kể.
Cũng trong số các hợp chất này, họ quyết định nghiên cứu một loại thuốc kháng sinh được gọi là clofoctol, hiện được sử dụng để điều trị n.hiễm t.rùng đường hô hấp do vi khuẩn.
Thử nghiệm loại thuốc này trên các mô hình chuột mắc COVID-19, đã ghi nhận clofoctol làm giảm tải lượng virus, giảm biểu hiện viêm và giảm bệnh lý phổi.
Giáo sư Jean Dubuisson, tác giả nghiên cứu, cho biết: Clofoctol ban đầu được phát triển như một loại thuốc kháng sinh để điều trị n.hiễm t.rùng đường hô hấp do vi khuẩn. Hợp chất này đã được chọn để đ.ánh giá thêm đối với SARS-CoV-2 trong các nghiên cứu trên động vật do các đặc tính dược lý của nó – nó có tính an toàn cao và tích lũy trong các mô phổi với nồng độ cao hơn trong huyết tương.
Các đặc tính chống virus và chống viêm của clofoctol, có thể đề xuất clofoctol như một ứng cử viên với giá cả phải chăng để điều trị bệnh nhân COVID-19. Tuy nhiên, cần có thêm các nghiên cứu trong tương lai để xác định lại những kết quả này trên người.
Thuốc Molnupiravir thứ 4 được cấp phép tại Việt Nam
Cục Quản lý Dược (Bộ Y tế) vừa quyết định cấp phép lưu hành thêm 1 loại thuốc Molnupiravir trong điều trị COVID-19 tại Việt Nam.
Thuốc Molnupiravir Stella 200 mg; hàm lượng Molnupiravir 200mg, dạng viên nang cứng, t.uổi thọ 6 tháng, hộp 4 vỉ x 10 viên. Số đăng ký là SĐK: VD3-174-22 của Công ty TNHH liên doanh Stellapharm – Chi nhánh 1 (Stellapharm J.V. Co., Ltd. – Branch 1) sản xuất và đăng ký.
Việc cấp phép cho loại thuốc này có hiệu lực 3 năm từ ngày ký ban hành quyết định.
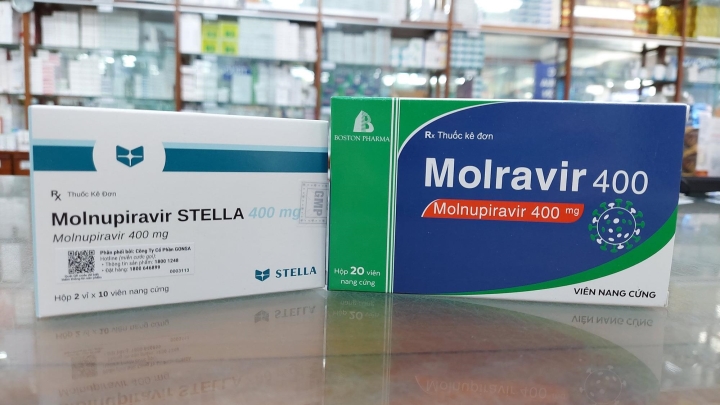
Thuốc Molnupiravir 400, một trong 4 thuốc được cấp phép lưu hành tại Việt Nam trong điều trị COVID-19. (Ảnh: Báo Chính phủ)
Như vậy, đến nay đã có 4 loại thuốc Molnupiravir – điều trị COVID-19 sản xuất trong nước được cấp phép lưu hành. Hồi tháng 2/2022, Cục Quản lý Dược cũng cấp phép cho 3 loại thuốc Molnupiravir khác, đó là Molravir 400: hàm lượng Molnupiravir 400 mg, dạng viên nang cứng, t.uổi thọ 6 tháng, do Công ty Cổ phần dược phẩm Boston Việt Nam sản xuất.
Movinavir hàm lượng 200 mg Molnupiravir, dạng viên nang cứng, t.uổi thọ 6 tháng, do Công ty cổ phần hóa dược phẩm Mekophar sản xuất. Molnuporavir Stella 400: hàm lượng 400 mg Molnupiravir, dạng viện nang cứng, t.uổi thọ 8 tháng, do Công ty TNHH Liên doanh Stellapharm – chi nhánh 1 sản xuất.
Sau khi cấp phép cho thuốc Molnupiravir thứ 4, Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng ký thuốc sản xuất theo đúng hồ sơ, tài liệu đăng ký với Bộ Y tế. Các đơn vị cần phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định.
Cục Quản lý Dược cũng yêu cầu các đơn vị tăng cường theo dõi, giám sát, phát hiện các trường hợp xảy ra phản ứng có hại của thuốc (nếu có), gửi báo cáo về Trung tâm Quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc (Hà Nội) hoặc Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc (TP.HCM) theo quy định.
