Nhóm các nhà khoa học Viện Vật liệu Ứng dụng đã phát triển thế hệ thuốc thông minh tự tìm diệt tế bào ung thư dùng hoạt chất thiên nhiên.
Điều trị đích tế bào ung thư
GS.TS Nguyễn Cửu Khoa – Viện Khoa học Vật liệu Ứng dụng cho biết, trong điều trị ung thư hiện đại, các nhà khoa học đang chuyển hướng nghiên cứu khả năng ức chế sự phát triển của tế bào ung thư bằng những hoạt chất có nguồn gốc thiên nhiên như như shogaol (gừng), curcumin (nghệ), fucoidan (rong nâu), apigenin (cần tây), vinblastin (dừa cạn)…
Ưu điểm của các hoạt chất này là ít có tác dụng phụ hơn các hợp chất hóa học, giá thành lại thấp. Tuy nhiên, nhược điểm là tính tan kém, cấu trúc cồng kềnh nên khả năng thấm qua màng tế bào thấp, không đủ hoạt lực để sử dụng làm thuốc do nồng độ hoạt chất trong m.áu rất nhỏ.
Để tăng hiệu quả sử dụng hoạt chất, các nhà khoa học dần ứng dụng liệu pháp hướng đích, sử dụng các hạt nano làm “vật tải” trong việc tải thuốc và nhả thuốc đúng địa chỉ. Khi đó, việc sử dụng công nghệ nano có thể tạo ra các hệ chất mang thuốc có kích thước cực nhỏ (20 – 200 nm) với một phần lipid trên bề mặt nên vừa có tính tan, vừa có tính thấm tốt qua màng tế bào để vào mạch m.áu. Do đó, hàm lượng hoạt chất trong m.áu sẽ được tăng lên gấp nhiều lần, đủ hoạt lực để được sử dụng làm thuốc.
Việc gắn thêm tác nhân hướng đích trên bề mặt hệ mang thuốc đưa tới tế bào ung thư một cách chủ định làm tăng hiệu lực của thuốc lên nhiều lần, giảm liều sử dụng và giảm tác dụng phụ.
Nhiệm vụ “Nghiên cứu công nghệ chế tạo các hệ nano chứa cao dược chất ứng dụng làm thuốc chống ung thư hướng đích” được nhóm các nhà khoa học Viện Vật liệu Ứng dụng thực hiện với mục tiêu chính là tổng hợp một số sản phẩm nano liposome gắn tác nhân hướng đích có chứa cao dược liệu trong hỗ trợ điều trị các căn bệnh ung thư.
Kết quả, nhóm thực hiện đã sản xuất thử nghiệm thành công 3 loại viên nang cứng, gồm: Viên nang cứng chứa nano liposome-FA hướng đích mang cao gừng (Shogaol), viên nang cứng chứa nano liposome-FA hướng đích mang cao rong nâu (Fucoidan), viên nang cứng chứa nano liposome-FA hướng đích mang cao cần tây (Apigenin).
Các sản phẩm này là thế hệ thuốc mới, mang tính chất “thông minh” hướng tới đích là các tế bào bệnh, giúp cho việc điều trị ung thư hiệu quả hơn, người bệnh ít chịu tác dụng phụ hơn và đặc biệt sẽ giảm được đáng kể chi phí điều trị.
Nhóm thực hiện cũng đã xây dựng các quy trình công nghệ, làm cơ sở khoa học cho những nghiên cứu tiếp theo trong lĩnh vực sản xuất thuốc chống ung thư thế hệ sử dụng các hoạt chất có nguồn gốc thiên nhiên từ Việt Nam.

Hiệu quả cao với ung thư phổi, gan và vú
GS.TS Nguyễn Cửu Khoa cho biết, các loại viên nang cứng được nhóm thực hiện bào chế theo quy trình tổng hợp các hệ nano từ các cao dược liệu và chế tạo hệ nano liposome hướng đích với tác nhân là acid folic (FA).
Sở dĩ chọn FA làm tác nhân hướng đích bởi dễ kiếm, đồng thời ứng dụng được cho nhiều loại tế bào ung thư. FA cần thiết cho sự tổng hợp và sao chép DNA, phân chia, phát triển của tế bào, đặc biệt là trong các tế bào phân chia nhanh chóng hoặc tế bào ung thư.
Sử dụng FA làm mục tiêu tế bào ung thư của vật liệu nano thuốc hóa trị liệu cũng đã được chứng minh trong những nghiên cứu khác nhau để cải thiện hiệu quả và hồ sơ an toàn của thuốc. Do đó, kết hợp FA với phân tử nano giúp tăng cường việc nhắm mục tiêu qua trung gian folate receptor của các tác nhân trị liệu.
Trong khi đó, liposome là những hạt lipid có cấu trúc vi thể, nhỏ hơn các tế bào m.áu hàng nghìn lần. Liposome thuộc hệ mang thuốc hướng đích (targetherd drug delivery system) có cấu trúc hình cầu đơn hay đa lớp kép gồm một nhân nước ở giữa được bao bọc bởi một vỏ phospholipid một hay nhiều lớp, có kích thước thay đổi từ hàng chục đến hàng nghìn nm.
Thành phần chính của liposome là phospholipid và cholesterol. Đây là những chất tương hợp sinh học, có thể phân giải được trong cơ thể nên ưu việt trong ứng dụng làm chất mang thuốc.
Khi sử dụng liposome làm chất mang thuốc, dược chất có thể phân bố trong khoang nước của liposome, phân bố giữa lớp phospholipid kép, tương tác và gắn với đầu không phân cực của phân tử phospholipid hoặc hấp phụ trên bề mặt của lớp phospholidpid kép tùy thuộc vào đặc tính thân dầu – nước của dược chất và tương tác hóa lý giữa dược chất với lớp phospholipid kép. Liposome có thể bao gói bên trong lớp lipid kép môi trường tối ưu cho sự ổn định của dược chất nhưng lại được phân tán trong môi trường có điều kiện tương tự điều kiện sinh lý của cơ thể. Do đó liposome được xem là một trong những hệ mang thuốc lý tưởng.
Thuốc chống ung thư cũng có thể hoạt động như liệu pháp kháng virus COVID-19
Theo nghiên cứu mới của Mỹ, biện pháp chống lại SARS-CoV-2, đặc biệt là các biến thể của chủng Omicron, có thể hiệu quả khi sử dụng thuốc chống ung thư.
Phương pháp này sử dụng một chất ức chế phân tử nhỏ (một phân tử có kích thước khoảng 1 nanomet) ức chế các tương tác cụ thể giữa các protein được gọi là RK-33 để ngăn chặn khả năng virus tiếp quản “nhà máy sản xuất gene” của tế bào chủ để tạo ra các bản sao của chính nó.
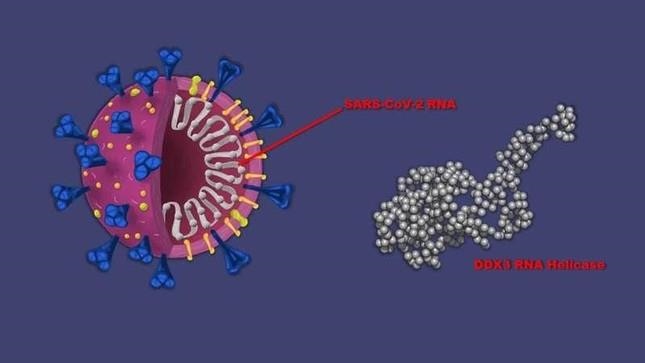
Mô hình nhân bản của SARS-CoV-2 9 (bên trái) và protein DDX3.
“Cho đến nay, vaccine COVID-19 đã dựa vào việc ngăn chặn sự liên kết của một protein bề mặt SARS-CoV-2 được gọi là protein đột biến với các tế bào chủ và gây n.hiễm t.rùng, nhưng nếu protein đột biến thay đổi theo các biến thể mới, thì hiệu quả của vaccine có thể bị suy yếu”, tác giả cao cấp của nghiên cứu Venu Raman, Tiến sĩ, giáo sư X-quang, ung thư và dược học tại trường Y thuộc Đại học Johns Hopkins cho biết.
Ông cho biết thêm: “Ngược lại, nghiên cứu của chúng tôi cho thấy khả năng kháng virus của RK-33 không bị ảnh hưởng bởi protein đột biến và vẫn nhất quán trên bốn biến thể SARS-CoV-2.”
Trong vài năm qua, Raman và các đồng nghiệp của ông đã nghiên cứu một loại protein được gọi là DDX3 và tác động của nó đối với bệnh ung thư. DDX3 một protein có chức năng tháo xoắn RNA kiểm soát nhiều tế bào khối u, cho phép đọc (hoặc dịch) mã di truyền của RNA. Điều này dẫn đến việc tạo ra các tế bào ung thư mới và sự lây lan ác tính của bệnh ung thư.
Các nghiên cứu của nhóm Raman và những nhóm nghiên cứu khác đã gợi ý rằng RK-33, một chất ức chế DDX3 được phát triển trong phòng thí nghiệm Raman, có thể làm chậm sự tiến triển của ung thư bằng cách giữ cho RNA không bị cuốn lại để dịch mã.
Protein DDX3 cũng đã được chứng minh là giúp thúc đẩy khả năng lây nhiễm của nhiều loại virus RNA, chẳng hạn như HIV và virus hợp bào hô hấp (RSV). Do đó, RK-33, chất ức chế DDX3 với nhiều hứa hẹn như một chất chống ung thư, hiện đang được xem xét nghiêm túc cho chức năng điều trị tiếp theo: một chất kháng virus phổ rộng.
Cùng với việc kiểm tra tác động của RK-33 đối với khả năng lây nhiễm và sinh sản của SARS-CoV-2, các nhà nghiên cứu đã mở rộng nghiên cứu của mình để xác định xem hoạt động ức chế được quan sát có giới hạn ở các biến thể cụ thể của virus hay sẽ hiệu quả với nhiều biến thể. Họ sử dụng RK-33 để nhắm mục tiêu DDX3 trong các tế bào phòng thí nghiệm bị nhiễm bốn biến thể của SARS-CoV-2 virus gốc và các biến thể alpha, beta và delta.
“Kết quả của chúng tôi chỉ ra rằng, đối với bốn biến thể SARS-CoV-2 mà chúng tôi đã thử nghiệm, việc xử lý RK-33 đối với các tế bào bị nhiễm cho thấy tải lượng virus giảm đáng kể, gấp một nghìn lần”, Raman nói.
Raman cho biết thêm rằng, RK-33 không chỉ hoạt động với bốn biến thể SARS-CoV-2, hoạt động kháng virus của protein không bị ảnh hưởng bởi các đột biến tạo ra.
Hiện tại, Raman và nhóm của ông đang xem xét RK-33 như một chất kháng virus chống lại biến thể Omicron của SARS-CoV-2. Các nhà nghiên cứu hy vọng sẽ công bố phát hiện này vào cuối năm nay.
