Cục Quản lý Dược (Bộ Y tế) vừa quyết định cấp phép lưu hành thêm 1 loại thuốc Molnupiravir trong điều trị COVID-19 tại Việt Nam.
Thuốc Molnupiravir Stella 200 mg; hàm lượng Molnupiravir 200mg, dạng viên nang cứng, t.uổi thọ 6 tháng, hộp 4 vỉ x 10 viên. Số đăng ký là SĐK: VD3-174-22 của Công ty TNHH liên doanh Stellapharm – Chi nhánh 1 (Stellapharm J.V. Co., Ltd. – Branch 1) sản xuất và đăng ký.
Việc cấp phép cho loại thuốc này có hiệu lực 3 năm từ ngày ký ban hành quyết định.
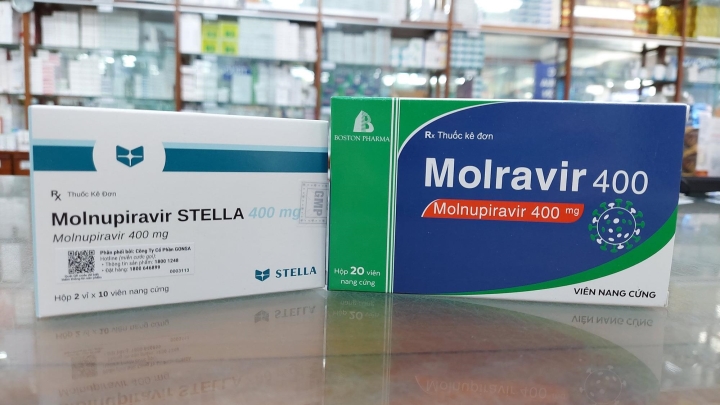
Thuốc Molnupiravir 400, một trong 4 thuốc được cấp phép lưu hành tại Việt Nam trong điều trị COVID-19. (Ảnh: Báo Chính phủ)
Như vậy, đến nay đã có 4 loại thuốc Molnupiravir – điều trị COVID-19 sản xuất trong nước được cấp phép lưu hành. Hồi tháng 2/2022, Cục Quản lý Dược cũng cấp phép cho 3 loại thuốc Molnupiravir khác, đó là Molravir 400: hàm lượng Molnupiravir 400 mg, dạng viên nang cứng, t.uổi thọ 6 tháng, do Công ty Cổ phần dược phẩm Boston Việt Nam sản xuất.
Movinavir hàm lượng 200 mg Molnupiravir, dạng viên nang cứng, t.uổi thọ 6 tháng, do Công ty cổ phần hóa dược phẩm Mekophar sản xuất. Molnuporavir Stella 400: hàm lượng 400 mg Molnupiravir, dạng viện nang cứng, t.uổi thọ 8 tháng, do Công ty TNHH Liên doanh Stellapharm – chi nhánh 1 sản xuất.
Sau khi cấp phép cho thuốc Molnupiravir thứ 4, Cục Quản lý Dược yêu cầu các cơ sở sản xuất và đăng ký thuốc sản xuất theo đúng hồ sơ, tài liệu đăng ký với Bộ Y tế. Các đơn vị cần phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định.
Cục Quản lý Dược cũng yêu cầu các đơn vị tăng cường theo dõi, giám sát, phát hiện các trường hợp xảy ra phản ứng có hại của thuốc (nếu có), gửi báo cáo về Trung tâm Quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc (Hà Nội) hoặc Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc (TP.HCM) theo quy định.
Phát hiện thuốc Molnupiravir giả ở Thụy Sĩ ghi ‘sản xuất tại Bình Dương’
Tối 5-5, Cục Quản lý dược (Bộ Y tế) có cảnh báo khẩn về việc phát hiện thuốc giả Molnupiravir tại Thụy Sĩ có thông tin tiếng Việt không dấu trên nhãn ở phần nơi sản xuất.
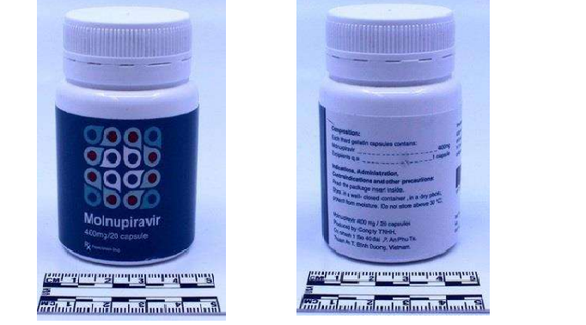
Hình ảnh thuốc giả Molnupiravir phát hiện tại Thụy Sĩ – Ảnh: Cục Quản lý dược cung cấp
Trước đó, Cục Quản lý dược cho biết vừa nhận được thông tin từ Văn phòng đại diện Tổ chức Y tế thế giới (WHO) tại Việt Nam gửi cảnh báo khẩn từ tổng hành dinh WHO liên quan đến thuốc giả Molnupiravir phát hiện tại Thụy Sĩ.
Theo đó, Hải quan Thụy Sĩ đã phát hiện thuốc giả Molnupiravir 400mg, dạng bào chế nang cứng, quy cách đóng gói lọ 20 viên, trên nhãn có ghi thông tin “Manufactured by Công ty TNHH, Chi nhanh 1 so 40 dai, P. An Phu, Tx. Thuan An, Tinh Binh Duong, Vietnam”.
Kết quả kiểm nghiệm thuốc cho thấy thuốc không chứa hoạt chất như ghi trên nhãn, xác định là thuốc giả.
Để đảm bảo an toàn cho người sử dụng và xử lý nghiêm vi phạm theo quy định của pháp luật, Cục Quản lý dược đề nghị sở y tế các tỉnh, thành phố trực thuộc trung ương thông báo cho các cơ sở kinh doanh, sử dụng thuốc và trên trang thông tin điện tử của sở y tế về thuốc giả Molnupiravir 400mg có các dấu hiệu nêu trên.
Đồng thời, các đơn vị phối hợp với các cơ quan truyền thông thông tin đến các cơ sở kinh doanh, sử dụng thuốc và người dân biết để không buôn bán, sử dụng thuốc giả Molnupiravir 400mg có các dấu hiệu nêu trên.
Cục Quản lý dược đề nghị các đơn vị tổ chức tiếp nhận thông tin, báo cáo của các cơ sở kinh doanh, sử dụng thuốc và phối hợp với các cơ quan chức năng liên quan kiểm tra xác minh, truy tìm nguồn gốc xuất xứ của thuốc giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành.
