Trao đổi với T.uổi Trẻ ngày 31-7, nhóm nghiên cứu vắc xin Nano Covax cho biết đang lấy mẫu đ.ánh giá tính an toàn và tính miễn dịch của vắc xin Nano Covax với 1.004 người tiêm ngừa đủ 2 mũi giai đoạn 3a.
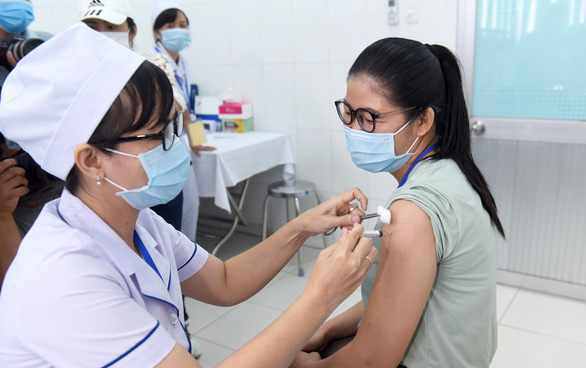
Tiêm thử nghiệm vắc xin Nano Covax ngừa COVID-19 cho tình nguyện viên tại tỉnh Long An – Ảnh: DUYÊN PHAN
Dự kiến hoạt động lấy mẫu sẽ kéo dài đến đầu tuần tới, nhưng các mẫu đã lấy từ giữa tháng 7 đến nay đã được chuyển đến đơn vị phụ trách đ.ánh giá kết quả (Viện Vệ sinh dịch tễ trung ương).
Nhóm nghiên cứu cũng cho biết đang gấp rút hoàn thiện các biểu mẫu để gửi báo cáo dữ liệu thử nghiệm lâm sàng giai đoạn 3 lên Bộ Y tế theo đúng yêu cầu của bộ là ngày 4-8.
Song song với quá trình này, nhà sản xuất sẽ hoàn thiện hồ sơ để gửi Bộ Y tế, các hội đồng chuyên gia, đề nghị được cấp phép khẩn cấp cho vắc xin Nano Covax.
Theo thông tin của nhà sản xuất, đã có xấp xỉ 14.000 người tham gia tiêm ngừa vắc xin Nano Covax ở 3 giai đoạn 1, 2, 3. Trong đó giai đoạn 3 gồm: 3a có 1.004 người tham gia, 3b có 12.000 người. Về cơ bản, vắc xin đảm bảo an toàn và sinh miễn dịch tương đương với các vắc xin nhập ngoại đang sử dụng.
Đại diện nhà sản xuất vắc xin cũng cho biết đã có thư ủy quyền cho đại sứ Việt Nam tại Ấn Độ Phạm Sanh Châu tham gia đàm phán để thử nghiệm lâm sàng vắc xin Nano Covax tại Ấn Độ. Ngoài ra còn một số quốc gia đề nghị chuyển giao công nghệ hoặc mua bán thành phẩm Nano Covax. Hiện các đề nghị này vẫn đang ở diện trao đổi.
Ngoài sản phẩm dạng tiêm, Nano Covax còn có sản phẩm sử dụng theo đường xịt mũi.
Thủ tướng Chính phủ cũng đã giao Bộ Y tế và Bộ Tư pháp tháo gỡ các vướng mắc về quy định để có thể cấp phép cho vắc xin.
Luật dược hiện hành yêu cầu thử nghiệm lâm sàng 3 giai đoạn và sản phẩm chứng minh được hiệu quả bảo vệ. Tuy nhiên, nếu chờ đủ các điều kiện này, thời gian chờ đợi sẽ rất lâu.
Kỳ họp Quốc hội vừa qua đã phê chuẩn nghị quyết, giao Thủ tướng quyết định cho phép việc sửa đổi các quy định pháp lý (hiện có vướng mắc là có cho phép cấp phép ở giữa kỳ thử nghiệm lâm sàng giai đoạn 3 và tiếp tục theo dõi chất lượng vắc xin do nhu cầu trong đại dịch hay không).
Các nước cấp phép vắc xin ra sao?
Theo quy trình sử dụng khẩn cấp, nhà sản xuất sẽ thử nghiệm 3 giai đoạn. Tuy nhiên vì là tình huống “khẩn cấp”, các nhà sản xuất vừa sản xuất số lượng lớn vắc xin vừa thử nghiệm. Sau khi được cấp phép khẩn cấp, họ sẽ phân phối số vắc xin này.
Việc cấp phép sử dụng khẩn cấp có ý nghĩa tương đối, tức được cấp phép ở Mỹ chưa chắc được cấp phép tương tự ở Việt Nam. Thời gian qua, WHO cũng chỉ xuất bản các tài liệu, hướng dẫn đ.ánh giá lâm sàng cũng như tiêu chuẩn vắc xin cho chính phủ các nước tham khảo, từ đó đưa ra quyết định của riêng quốc gia ấy.
Hiện nay, vắc xin Nano Covax của Việt Nam cũng đang hoàn tất các giai đoạn cuối cùng và đã công khai dữ liệu t.iền lâm sàng và lâm sàng. Dữ liệu của Nano Covax được công bố dạng bản thảo (preprint) chưa bình duyệt trên hai kho dữ liệu mở Biorxiv và Medrxiv.
Các bản preprint này là tài liệu nghiên cứu đầy đủ liên quan tới một nghiên cứu. Việc đăng tải công khai preprint sẽ giúp các nhà nghiên cứu “đ.ánh dấu” nghiên cứu của mình để phục vụ vấn đề bản quyền, cũng như đón nhận các trích dẫn, phản hồi… từ các nghiên cứu hoặc bài báo khác.
Vắc xin Nano Covax thử nghiệm trên 14.000 người, không ai có phản ứng nặng
Tổng giám đốc Công ty Nanogen Hồ Nhân cho biết quá trình thử nghiệm vắc xin Nano Covax trên 14.000 người không ai có phản ứng nặng, không có ca t.ử v.ong, tỉ lệ phản ứng rất thấp.
Siemens Healthineers & Nanogen hợp tác ở giai đoạn thử nghiệm lâm sàng vaccine COVID-19 Nanocovax Đọc báo cùng bạn 24-6: Kiến nghị phê duyệt khẩn cấp vắc xin, Nanogen có nóng vội? Chủ tịch nước Nguyễn Xuân Phúc yêu cầu Bộ Y tế cấp phép sớm cho vắc xin Nano Covax

Chủ tịch nước Nguyễn Xuân Phúc làm việc với Công ty Nanogen – Ảnh: H.G
Chiều tối 29-7, trong chuyến công tác tại TP.HCM, Chủ tịch nước Nguyễn Xuân Phúc thăm, làm việc với Công ty cổ phần công nghệ sinh học dược Nanogen để nghe báo cáo về tiến độ thử nghiệm vắc xin Nano Covax.
Tại cuộc họp, ông Hồ Nhân – tổng giám đốc Công ty cổ phần công nghệ sinh học dược Nanogen – cho biết khi được giao nhiệm vụ sản xuất thuốc và vắc xin phòng, chống dịch, công ty đã huy động cả ngàn người để tham gia nghiên cứu sản xuất vắc xin Nano Covax.
Đến tháng 12-2020, công ty đã tiêm mũi đầu tiên của Nano Covax và cho đến nay đã có 7 tháng thử nghiệm với giai đoạn 1, 2 và 3A. Qua thử nghiệm giai đoạn 3A, vắc xin không cho thấy yếu tố bất lợi; đáp ứng khả năng sinh miễn dịch và trung hòa tốt kể cả chủng Delta.
Quá trình thử nghiệm trên 14.000 người không ai có phản ứng nặng, không có ca t.ử v.ong, tỉ lệ phản ứng rất thấp.
Ông Nhân cho biết hiện nay có khoảng 30 nước yêu cầu chuyển giao công nghệ, trong đó có Ấn Độ. Bên cạnh đó, Tổ chức Y tế thế giới (WHO) cũng đang thẩm định hồ sơ vắc xin của Nanogen để “hòa nhập” vắc xin với thế giới.
Về vấn đề sản xuất, hiện nay công ty có thể sản xuất trên 10 triệu liều/tháng và có thể sản xuất 30 triệu liều/tháng vào tháng 10.
Ông Nhân cho rằng trong giai đoạn cấp bách hiện nay, đề nghị Chủ tịch nước kiến nghị Thủ tướng và các cấp ngành cấp giấy phép khẩn cấp có điều kiện cho vắc xin Nano Covax trong tuần này hoặc tuần sau và tiếp tục thử nghiệm giai đoạn 3B, 4.

Chủ tịch nước Nguyễn Xuân Phúc phát biểu tại cuộc họp – Ảnh: H.G
Chủ tịch nước Nguyễn Xuân Phúc đ.ánh giá vấn đề sản xuất vắc xin trong nước là rất cấp bách trong tình hình dịch diễn biến phức tạp mà vắc xin lại đang khan hiếm.
“Chúng ta phải xem vắc xin là vấn đề khẩn cấp quốc gia, vắc xin trong nước thể hiện tinh thần tự lập, tự cường, độc lập tự chủ trong bảo đảm an ninh y tế, chăm sóc sức khỏe của nhân dân”, Chủ tịch nước nói.
Chủ tịch nước cho biết ông đã tích cực đi ngoại giao vắc xin, có nhiều cuộc điện đàm nhưng vắc xin quá khan hiếm. Công thức chống dịch của Việt Nam là 5K vắc xin. Tình hình dịch bệnh phức tạp, vấn đề vắc xin và giãn cách xã hội là phương châm hàng đầu trong vấn đề phòng, chống dịch.
Do đó, Chủ tịch nước Nguyễn Xuân Phúc yêu cầu Bộ Y tế và các đơn vị liên quan tạo mọi điều kiện thuận lợi cho việc sản xuất vắc xin trong nước, cải cách thủ tục hành chính, tổ chức nhanh các quy trình chuyên môn để có vắc xin nhưng phải tuyệt đối đảm bảo an toàn tính mạng của nhân dân.
Chủ tịch nước cũng cho biết ông cùng Thủ tướng Phạm Minh Chính thống nhất mời đại diện WHO tham gia đ.ánh giá vắc xin.
“Khi chúng ta thử nghiệm số lượng lớn như thế rồi, tôi luôn hỏi về việc đảm bảo an toàn. Thử nghiệm 14.000 người có ai t.ử v.ong không, có phản ứng nặng không để chúng ta quyết định chủ trương sớm hơn, không để người dân đang rất cần vắc xin mà chúng ta cứ chậm vấn đề này”, Chủ tịch nước nhấn mạnh.
Chủ tịch nước yêu cầu các bộ ngành đ.ánh giá khoa học, khách quan về vắc xin trong bối cảnh cấp bách. Chủ tịch nước yêu cầu Bộ Y tế xem xét cấp phép sớm để vắc xin đưa vào sử dụng.
Đồng thời Chủ tịch nước cũng cho rằng Công ty Nanogen phải không ngừng cải thiện công nghệ, nâng cao chất lượng vắc xin và giảm thiểu tác động xấu không mong muốn.
“Nghiên cứu cho thấy chu kỳ 8 tháng đến 1 năm phải tiêm vắc xin lại nên nhu cầu sản xuất vắc xin trong nước vô cùng lớn. Toàn thế giới thiếu vắc xin, cho nên chúng ta phải suy nghĩ vắc xin Việt Nam không chỉ phục vụ tại Việt Nam mà phải vươn ra thế giới”, Chủ tịch nước nói.
